Contents
Inleiding
Eiwitten zijn lange strengen van aminozuren die veel belangrijke processen in het menselijk lichaam beregelen. Het is bekend dat eiwitten 'opgevouwen' in de lichaamscellen opgeborgen zitten, en dat de specifieke vouwing is bepalend voor de functie; verkeerd gevouwen eiwitten staan aan de basis van onder andere kanker, Alzheimer en taaislijmziekte. Het is daarom van groot belang voor zowel de farmaceutische industrie als de medische wetenschap om iets te kunnen zeggen over de exacte vorm van de vouwing.
Gelukkig is er is het één en ander bekend over het mechanisme achter de vouwing: hydrofobe aminozuren (H) willen graag 'naast elkaar' liggen, polaire aminozuren (P) hebben die voorkeur niet. Als twee hydrofobe aminozuren naast elkaar liggen ontstaat er namelijk een 'bond' door de aantrekkende kachten tussen de twee en hoe meer bonds, hoe stabieler het eiwit.
In deze case
a) Schrijf een algoritme dat eiwitten 1, 2, 3, 4 en 5 kan vouwen naar een stabiele conformatie in 2 dimensies (tabel S1)
Opdracht
a) Schrijf een algoritme dat eiwitten 1, 2, 3, 4 en 5 kan vouwen naar een stabiele conformatie in 2 dimensies (tabel S1)
b) Voeg een dimensie toe (3D) en probeer eiwitten 1, 2, 3, 4 en 5 nogmaals te vouwen naar de meest stabiele conformatie.
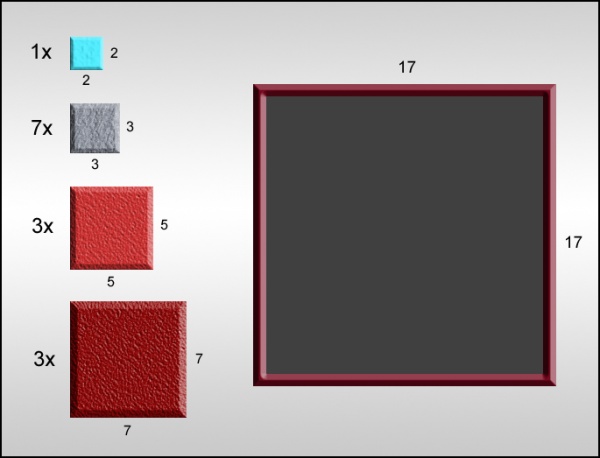
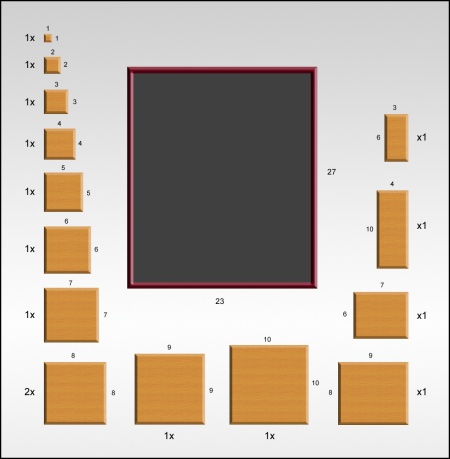
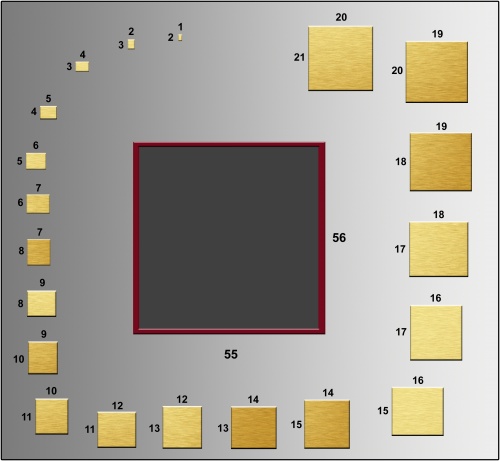
c) Verzin een algoritme om tegelset #3 in het bijgeleverde invoervak te zetten. Een zetting is correct als er geen tussenruimte tussen de tegels is, en tegels elkaar niet overlappen.
Advanced
d) Genereer zelf random eiwitten, en probeer te bepalen welke eigenschappen ervoor zorgen dat een eiwit moeilijk te vouwen is.
Links
Best leuk om even te kijken naar perfect squares op WolframMathWorld.
Terug
Terug naar de Heuristieken hoofdpagina.